
.
تُعرَّف شيخوخة المناعة بأنها مجموعة تغيّرات تدريجية تصيب الجهاز المناعي مع التقدم في العمر فتُضعف قدرته على مواجهة العدوى والاستجابة للقاحات ومراقبة الخلايا المتحوّلة التي قد تقود إلى السرطان، وفي الوقت نفسه قد تدفعه نحو نمط التهابي مزمن منخفض الدرجة يرافق الشيخوخة ويُشار إليه كثيرًا باسم “الالتهاب المُزمن المرتبط بالعمر”. جوهر المشكلة ليس “ضعف المناعة” بشكل عام بقدر ما هو اختلال في التوازن بين أذرع متعددة: المناعة الفطرية التي تميل لدى كثير من كبار السن إلى فرط الاستجابة أو الاستجابة غير الدقيقة، والمناعة التكيفية التي تتراجع فيها جودة الخلايا التائية والبائية وقدرتها على تكوين ذاكرة فعّالة.
أحد أكثر المفاتيح وضوحًا في هذا المشهد هو الغدة الزعترية (الثيموس) التي تُعد مدرسة نضج الخلايا التائية؛ إذ تتراجع وظيفتها وحجمها مع العمر، فينخفض إنتاج الخلايا التائية “الجديدة” القادرة على التعرف على مستضدات غير مألوفة، وتزداد نسبة الخلايا التائية المُنهَكة أو المُتقدّمة في العمر التي تحمل ذاكرة قديمة لكنها أقل مرونة أمام تهديدات جديدة. هذا يفسّر لماذا قد تبدو بعض اللقاحات أقل فعالية عند المسنين ولماذا ترتفع شدة بعض العدوى ومضاعفاتها، ولماذا تصبح علاجات مناعية معينة للسرطان أقل اتساقًا في النتائج مع التقدم في العمر.
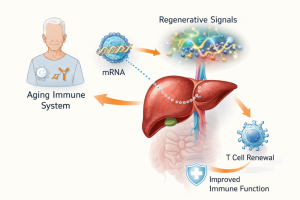
هنا بالضبط ظهرت فكرة جذابة علميًا في 2024–2025: بدل أن نطارد كل مظاهر شيخوخة المناعة دفعة واحدة، هل يمكن إعادة تفعيل “الإشارات الأساسية” التي كانت تدعم إنتاج الخلايا التائية ونضجها حين كنّا أصغر سنًا، ولو بشكل مؤقت وآمن، بحيث نستعيد جزءًا من القدرة المناعية عندما نحتاجها، مثل مواسم اللقاحات أو أثناء علاج مناعي للسرطان؟ تقنية mRNA، التي تعلّم العالم استخدامها على نطاق واسع مع لقاحات كوفيد-19، قدّمت منصة مناسبة لهذه الفكرة لأنها بطبيعتها مؤقتة؛ فهي لا تغيّر الجينوم ولا تزرع تعديلًا دائمًا، بل تُنتج بروتينات محددة لفترة قصيرة ثم تختفي، وهذا بالضبط ما تريده عندما تفكر في “تعزيز” جهاز مناعي مُسن دون أن تخاطر بدفعه إلى اضطراب طويل الأمد. الجديد في الأعمال الأحدث أن الباحثين لم يكتفوا بإعطاء “منشّط مناعي” عام، بل صمموا استراتيجية أقرب إلى إعادة بناء مسار نمائي: جعل عضو آخر في الجسم يؤدي مؤقتًا وظيفة إشارات كانت تصدر في الأصل من الثيموس.
الفكرة التي لفتت الانتباه بقوة في نهاية 2025 هي استخدام mRNA محمّلًا في جسيمات دهنية نانوية بحيث يصل إلى الكبد، ثم يجعل خلايا الكبد تُنتج مزيجًا من عوامل إشارات معروفة بدورها في دعم تكوّن الخلايا التائية ومساراتها المبكرة، وبذلك يتحول الكبد لفترة وجيزة إلى “مصنع” لإشارات تعويضية تُنشّط مسارات تكوين المناعة التكيفية لدى الحيوان المُسن. علميًا، أهم ما في هذا النهج أنه يستهدف عنق زجاجة معروفًا في شيخوخة المناعة: نقص الإشارات التي تُعيد تغذية مسار إنتاج الخلايا التائية ونضجها، بدلًا من محاولة “إعادة شباب” كل خلية متقدمة في العمر على حدة. وفي التجارب قبل السريرية على الفئران، جرى اختبار مزيج ثلاثي من عوامل إشارية (يُشار إليها أحيانًا اختصارًا كحزمة واحدة) قُدّمت عبر mRNA، والنتيجة التي وُصفت في تقارير متعددة هي تحسن مؤشرات إنتاج الخلايا التائية وزيادة كفاءة الاستجابة المناعية في نماذج تلقيح، وكذلك تحسن في أداء علاجات مناعية معينة ضد السرطان مقارنة بفئران مسنة لم تتلقَّ هذا التدخل.
ما يهم هنا ليس فقط “زيادة العدد” بل جودة الوظيفة
قدرة الخلايا التائية على الانقسام المناسب عند التعرض للمستضد، وتحسين التوازن بين الأنماط الوظيفية، وتقليل بصمات الإنهاك في بعض السياقات، وهي أمور إن ثبتت لاحقًا في نماذج أقرب إلى الإنسان فستكون خطوة كبيرة لأن كثيرًا من إخفاقات اللقاحات لدى كبار السن ليست بسبب غياب الأجسام المضادة فقط بل بسبب ضعف التنسيق المناعي الذي تقوده الخلايا التائية. مع ذلك، يجب التعامل مع هذه النتائج بقدر عالٍ من الحذر العلمي؛ فالفأر ليس إنسانًا، والزمن المناعي للفأر مختلف، كما أن “إعادة تشغيل” مسارات تكوّن المناعة قد تحمل مخاطر إذا نُفذت بجرعات غير مضبوطة أو في أشخاص لديهم استعدادات كامنة لاضطرابات مناعية أو حالات التهابية مزمنة أو أمراض خبيثة غير مكتشفة. ولذلك تبدو ميزة mRNA هنا مزدوجة: هي أداة قوية لأنها تُنتج بروتينات بكفاءة داخل الجسم دون تصنيع بروتينات خارجية معقد، وهي أيضًا أداة أكثر قابلية للضبط لأن تأثيرها يتلاشى بعد توقف الجرعات، ما يفتح الباب لمنطق علاجي يقوم على “نوافذ دعم” قصيرة بدل التعزيز المستمر.
وإذا انتقلنا من “تجديد الخلايا التائية” إلى مفهوم أوسع، نجد أن 2024–2025 شهدت أيضًا توسعًا في فهم أثر mRNA على المناعة الفطرية. كان الاعتقاد الشائع عند إطلاق لقاحات mRNA أن دورها الأساسي هو تقديم شفرة لإنتاج بروتين مستضدي (مثل بروتين شوكي) ومن ثم تحفيز المناعة التكيفية.
لكن تجارب حديثة أشارت إلى أن هذه اللقاحات قد تترك آثارًا أطول نسبيًا على المناعة الفطرية عبر إعادة برمجة وظيفية لخلايا مثل الوحيدات والخلايا المقدِّمة للمستضد، وهو ما يندرج تحت مفهوم “المناعة المُدرَّبة”؛ أي ذاكرة وظيفية للمناعة الفطرية ليست ذاكرة مستضدية دقيقة مثل الأجسام المضادة، لكنها تحسّن الاستجابة العامة لبعض الإشارات الالتهابية اللاحقة. هذا المسار مهم في سياق شيخوخة المناعة لأن المناعة الفطرية لدى المسنين كثيرًا ما تكون مشوشة بين فرط الالتهاب وضعف الفاعلية، وأي تدخل يهدف إلى تحسينها يجب أن يوازن بين رفع الكفاءة ومنع زيادة الالتهاب المزمن.
هنا تتضح فلسفة جديدة لعلاجات mRNA خارج إطار “لقاح ضد جرثومة محددة”: استخدام mRNA كوسيلة لإنتاج بروتينات تنظيمية أو عوامل نمو أو إشارات مناعية تُعيد ضبط الشبكة المناعية بدل توجيهها نحو مستضد واحد فقط. وفي هذا الإطار، يصبح السؤال الواقعي ليس “هل سنعكس الشيخوخة؟” بل “هل نستطيع تحسين القدرة المناعية في نقاط ضعف محددة وبشكل آمن ومؤقت؟” الإجابة العلمية الأقرب اليوم: ربما، لكن عبر خطوات صغيرة مدروسة. التحديات التقنية ليست بسيطة.
أول تحدٍ هو التوصيل والتموضع: أين يجب أن تصل جسيمات mRNA؟ الكبد موقع مناسب لأنه عضو غني بالتروية ويستقبل الجسيمات الدهنية بسهولة نسبيًا، لكنه ليس عضوًا مناعيًا تقليديًا، وتحويله إلى منصة لإفراز عوامل مناعية يجب أن يُدرس من منظور السلامة الأيضية والالتهابية.
ثاني تحدٍ هو الجرعة والجدولة: شيخوخة المناعة ليست حالة تُصلحها حقنة واحدة، لكن في الوقت نفسه تعزيزًا متكررًا قد يحمل مخاطر تحفيز مناعي زائد أو اضطراب في توازن الخلايا.
ثالث تحدٍ هو اختلاف البشر: كبار السن ليسوا مجموعة واحدة؛ هناك فروق كبيرة في العمر البيولوجي، والأمراض المصاحبة، والأدوية المثبطة للمناعة، وحالة التغذية والميكروبيوم، وكلها تؤثر في الاستجابة.
رابع تحدٍ هو قياس النجاح: في اللقاحات نقيس الأجسام المضادة والاستجابة الخلوية، لكن في “تعزيز المناعة ضد الشيخوخة” نحتاج مجموعة مؤشرات مركبة: تنوع مستقبلات الخلايا التائية، جودة الذاكرة المناعية، مؤشرات الإنهاك، مستويات الالتهاب، والاستجابة الفعلية للعدوى أو اللقاح، وهذا يجعل تصميم التجارب السريرية أكثر تعقيدًا وأطول زمنًا.
خامس تحدٍ هو المخاوف النظرية حول السرطان والمناعة الذاتية: أي تدخل يزيد من ديناميكية الخلايا اللمفاوية يجب أن يُفحص بعناية من حيث احتمال دفع خلايا متحولة إلى الإفلات أو زيادة فرص تفاعل مناعي مع الذات لدى أشخاص لديهم استعدادات كامنة.
لذلك يميل الباحثون إلى تصور استخدامات أولية “محكومة”: دعم استجابة لقاح موسمي لدى كبار سنّ معروفين بضعف الاستجابة، أو دعم مؤقت قبل/خلال علاج مناعي للسرطان لتحسين فرص الاستفادة، أو ربما دعم مناعي بعد عدوى قاسية أضعفت مخزون الخلايا التائية. وفي الخلفية يبقى الدرس الأكبر من تجربة لقاحات mRNA: التكنولوجيا نفسها ليست هي العلاج، بل ما نكتبه في الشفرة وكيف نوصله ومتى نوصله ولمن. قد يبدو الأمر للوهلة الأولى وكأنه انتقال من “لقاح” إلى “إكسير شباب”، لكنه في الحقيقة انتقال إلى طب تنظيم شبكي: إصلاح إشارات مفقودة، تقليل اختناقات مسارية، ورفع كفاءة استجابات معروفة بالضعف في الشيخوخة.
وإذا نجحت هذه المقاربة في الانتقال إلى الإنسان، فهي قد تغيّر أولويات الطب الوقائي لكبار السن من مجرد توسيع جداول التطعيم إلى بناء “جاهزية مناعية” قابلة للرفع عند الحاجة، مع الاعتراف بأن الشيخوخة ليست مرضًا واحدًا بل مسار طويل تتداخل فيه المناعة مع الاستقلاب والأوعية والهرمونات والميكروبيوم.
وفي كل الأحوال، القيمة العلمية الكبرى لما حدث في 2024–2025 ليست إعلان حل نهائي، بل إعادة تعريف ما يمكن أن تفعله mRNA: ليس فقط إنتاج مستضد لمواجهة فيروس، بل إعادة تكوين إشارات داخلية تعيد بعض وظائف المناعة التي يستهلكها العمر، على أن يكون ذلك تحت سقف صارم من الدليل والرقابة، لأن أي خطوة في اتجاه “تعديل الشيخوخة” يجب أن تُعامل بحساسية أعلى من علاج مرض حاد، فالفائدة المحتملة واسعة لكن المخاطر أيضًا قد تكون ممتدة وطويلة الأمد.
.
المصادر
Restoring youth to old immune cells: mRNA therapy turns back the clock (Nature News, 2025)
https://www.nature.com/articles/d41586-025-04082-5
New study suggests a way to rejuvenate the immune system (MIT News, 2025)
https://news.mit.edu/2025/new-study-suggests-way-rejuvenate-immune-system-1217
Transient hepatic reconstitution of thymic factors using mRNA (ScienceDirect, 2025)
https://www.sciencedirect.com/science/article/pii/S0006497125029556
mRNA rejuvenates aging immune system – the liver as a fountain of youth (DKFZ Press Release, 2025)
https://www.dkfz.de/en/news/press-releases/detail/mrna-rejuvenates-aging-immune-system-the-liver-as-a-fountain-of-youth
mRNA-based COVID-19 vaccines train the long-term memory of the immune system (ScienceDaily, 2025)
https://www.sciencedaily.com/releases/2025/03/250326123320.htm
.
تواصل مع الكاتب: drsamirabdulhamid@gmail.com