.
منذ انطلاق فكرة “الجزيئات الدقيقة” في العلاج فإنّ الطب النانوي يقف عند مفترق قرارات: هل يمكن أن نعالج السرطان من الداخل، ليس فقط بقصف الخلايا أو استئصال الورم، بل بإرسال جيوش ميكروسكوبية إلى قلب الخلية السرطانية ذاتها؟
هذا السؤال لم يكن مجرد فكرة مستقبلية، بل أصبح اليوم واقعًا حقيقيًا في مختبرات علوم الحياة وقد تراكمت له أدلة علمية متقدمة تستعد للدخول في التطبيقات السريرية.
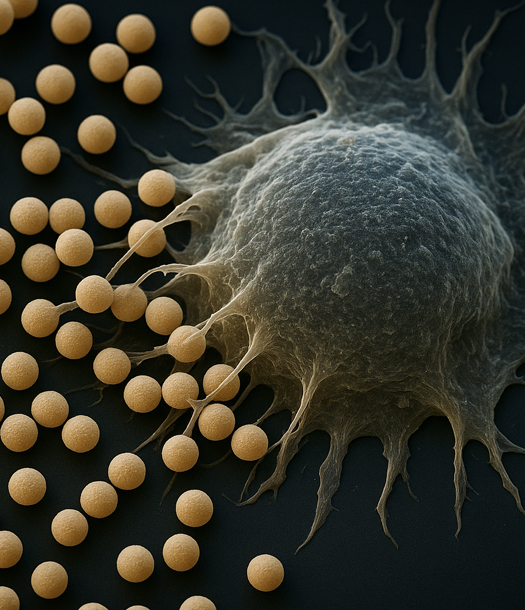
السر يكمن في حجم الجزيئة. فعند تقليص المكون العلاجي إلى مقاييس النانومتر 1-100 نانومتر تتغيّر قواعد اللعبة، لأن هذه الجزيئات يمكن أن تدخل الأنسجة المريضة بطرق لا تصلها الأدوية التقليدية، وتتفادى أنظمة الدفاع الحيوي التي تمنع الوصول إلى الخلايا السرطانية.
من هنا بدأت فكرة ناقل الجزيئات الجزريّة، حبث يلتقط الورم هذه الجسيمات الصغيرة بفضل النفاذية المتزايدة للأوعية الدموية في أنسجته، ثم يتحرّك الدواء مباشرة إلى قلب المشكلة. هذه الخاصية المسماة بـ “effect enhanced permeability and retention” (EPR) تمثل خطوة أولى على طريق العلاج الذكي.
لكن لا يكفي أن يصل الدواء، بل يجب أن يعرف الهدف. هنا تدخل التكنولوجيا النانوية المتخصصة بتعديل سطح الجزيئات بحيث تحمل علامات موجهة ligands تلتصق بخلايا الورم أو المستقبلات الخاصة بها، ثم تُفرغ المحتوى أو تُفعّل بمجموعة من المحفِّزات الداخلية، مثل تغيّر الحمضية داخل الورم أو الحرارة أو إنزيمات معينة. بهذه الطريقة، تُمكّن الجزيئات الدقيقة من تحقيق ما يشبه “قنبلة ذكية” تخرج سُمّيتها المحلية بل تُخفّف الضرر المحيط. وقد أظهرت مراجعات حديثة أن هذه الاستراتيجيات – من الليبوزومات والدندريمرات والجسيمات المعدنية إلى البوليمرات الحيوية – قد حسّنت كثيرًا فعالية العلاجات التقليدية مثل الكيميائي والإشعاعي.
أحد الأفاق الواعدة أيضاً هي الدمج بين “العلاج والتشخيص”، في نانوسكوب يُسمّى “Theranostics”k، فالجسيمات لا تحمل فقط دواءً، بل تحمل علامة تصوير أو مستقبلًا تُستخدم لرصد تحركها داخل الجسم، مما يمنح الطبيب نظرة داخلية فورية لمدى وصول العلاج وتأثيره، مع إمكانية تعديل المسار لحظة بلحظة. هذا التطور يشكّل نقطة فاصلة بين ما كنا نسميه العلاج والكشف، ويدخلنا في زمن جديد يمكن فيه أن نرى الورم ويتحكم فيه بنفس الأداة.
ولكن، كما هو الحال مع كل ثورة تقنية، ثمة عقبات جليّة. من أهمها مشكلة الترجمة من المختبر إلى المريض، إذ أن كثيرًا من أنظمة الجسيمات الدقيقة لا تزال حبراً على ورق أو في تجارب حيوانية ولم تعش بعد اختبار الإنسان في نطاق واسع. إضافة إلى ذلك، يواجه الطب النانوي تحدّيَ الأمان: فالجسيمات قد تُفعل جهاز المناعة أو تُحدث سمّية غير مقصودة أو تبقى في الأعضاء لتكوّن تراكمًا. كذلك، فإنّ تصميم الجزيئات يُضيف تعقيدات إنتاجية وتنظيمية ترفع من تكلفة العلاج وتطيل فترة الوصول إليه.
من منظور سريري، بدأنا نشهد تجارب واعدة. فعلى سبيل المثال، ظهرت دراسات تُستخدم فيها الجسيمات المشتقة من الذهب أو الحديد لتحفيز العلاج الحراري داخل الورم أو تحسين امتصاص الأشعة، ما يقلّل الورم ويمنع انتشاره. كما أن الدمج بين النانو والعلاج المناعي يُعدّ مفتاحًا لفتح الباب أمام حالات كانت تستعصي على الاستجابة من قبل، حيث تُعيد الجسيمات الدقيقة توجيه الجهاز المناعيّ نحو الخلايا السرطانية بشكل أكثر دقة وفعالية.
المريض ليس مجرد عضو يُحقن فيه دواء نانوي، بل شريك في رحلة يجب أن يعيها، ضمن بيئة رعاية متكاملة تشمل الجسد والعقل والبيئة. كما أن الأطباء والمختصين يتحمّلون مسؤولية حديثة تضاهي الابتكار: التأكُّد من أن الجزيئات النانوية لا تتحول من أصدقاء العلاج إلى مصادر خطورة، وأن نتائجها تُجمع وتُقيّم في مسارات تنظيمية صارمة، لتصبح ضمن استراتيجيات علاج معتمدة لا تجاربٍ تجريبية فقط.
وأمام هذا كله، تبرز مسألة العدالة في الوصول إلى هذه العلاجات النانوية، خاصة في الدول التي تفتقر للبنية التحتية أو التمويل الكافي. إنّ ما يُعرَف بالطب النانوي لا يصبح ثورة حقيقية إلا إذا تجاوز حدود المختبر والمراكز البحثية ليصل إلى المرضى في كل أنحاء العالم، بغضّ النظر عن المكان الجغرافي أو القدرة المالية. إن إنجاح هذا التكامل بين التقنية والإنسان سيكون المقياس الحقيقي لنجاحه.
يمكن القول إن الطب النانوي يجمع بين الحلم والواقع: الحلم بأن نُغلب السرطان من الداخل، والواقع أن لدينا اليوم أدوات أكثر دقة وذكاءً وأقرب للتطبيق مما كنا نعتقد قبل عقد واحد من الزمن. لكن الطريق لا يزال طويلاً وما من وصفة سريعة أو معجزة فورية: إنما هو نقلة نوعية تتطلب جهداً جماعياً، بنية تحتية، تنظيمًا، ووعيًا إنسانيًا.
عندما نُحقّق ذلك، قد نصل إلى زمن لا يكون فيه السرطان مجرد معركة، بل مجرد مرحلة يمكن حلّها ضمن ترسانة ذكية من الجزيئات الدقيقة والقرار العلاجي المتنبه.
.
المصادر
Nanotechnology in cancer treatment: revolutionizing strategies against drug resistance.
https://doi.org/10.3389/fbioe.2025.1548588
Nanomedicine in Cancer Therapeutics: Current Perspectives from Bench to Bedside.
https://doi.org/10.1186/s12943-025-02368-w
Cancer nanomedicine: Concepts, promises, and challenges.
https://doi.org/10.1016/j.crci.2025.100238
ecent advancements in nanotechnological strategies and applications.
https://doi.org/10.1039/d5na00390c
Recent advances in nanopharmaceutical strategies for cancer treatment.
https://doi.org/10.1016/j.biocel.2025.107915
.
تواصل مع الكاتب: drsamirabdulhamid@gmail.com