في سنة 1890م كان "إيرنست هانكين" يدْرُس تَفَشِّي بكتيريا الكوليرا على ضفاف نهر "جانجين Ganges" في الهند، نظراً لأن طائفة الهندوس كانوا يُلقون برُفات موتاهُم في ذلك النهر، مما أدى إلى تحوُّل النهر إلى مرتع للأوبئة والأمراض الفتَّاكة؛ التي زحفتْ إلى المُدن والقُرى المجاورة للوادي. وقد لاحظ "هانكين" وجودَ شيءٍ ما غامضٍ في ماء النهر يَقتُلُ البكتريا ومِن ثم يقضي على المرض بسرعة؛ وظل هذا الأمر لُغزا محيرا للعالِم "هانكين" الذي تعذَّرَ عليه تفسيرَ هذه الظاهرة الغريبة والمُحيِّرة.
وفي سنة 2013م استطاع العالـِم "جرمي بار" اكتشاف هذا السر وإزاحة اللثام عن هذا المنقذ الـمُسمى بـلاقِمِ البكتريا "البكتريوفاج Bacteriophage"، وهي فيروسات تتكون فقط من حامض نووي وبروتين. ورغم أنه غاية في الضآلة إلا أنه استطاع أن يقضيَ على بكتريا الكوليرا في ماء النهر؛ دون أن يتسبب في تلويث الماء أو تغيير خاصياتِه الطبيعية، لذا فإن بعض الباحثين أطلقوا على هذه الفيروسات اسم "فيروسات النينجا" وذلك لخاصيتِها الفتاكة والمدمرة للبكتريا الضارة للإنسان.
مع بداية حقبة المضادات الحيوية واكتشاف "البنسلين"، تم إنقاذ حياةِ الملايين من الموت المحقق بسبب الإصابات البكتيرية، مما جعل استخدام هذه المضادات أمراً ضروريا لا محيدَ عنه. إلا أن الإفراط في استخدامِها نتجَ عنه سلالاتٍ بكتيريةٍ مُقاومِة لتلك المضادات الحيوية؛ مما شكَّل تهديدا وخطورة أكبر على حياة الملايين من البشر عبر العالم. وإذا كان عدد تلك الأنواع المقاوِمة للمضادات الحيوية قد وصل إلى مئات الآلاف من البكتيريا والفيروسات، فإنه وبحلول سنة 2050م يُقدر العلماء وصول هذا الرقم إلى عشرة ملايينِ بكتيريا وفيروسٍ مقاومٍ تقريباً. مما سيهدد حياة الملايين عبر العالم؛ خاصة الأطفال وكبارَ السّن وضعيفي المناعة.
تكمن خطورة هذه المضادات في كونها لا تميز ولا تفرّق بين البكتيريا النافعة والبكتيريا الضارة للإنسان، وبالتالي فهي تقتل وتُبيد جميع أنواع البكتيريا التي تصادفها داخل جسم الإنسان، ومن جهة أخرى يؤدي سوء استعمال هذه المضادات إلى تمكين البكتيريا من تقوية مناعتها ضد هذه المضادات الحيوية؛ فيصبح الميكروب أقوى وأشد مقاومة لهذه المضادات. لذا اجتمع ثلة من الباحثين والخبراء والأطباء خلال الندوة التي انعقدتْ في سيدني بأستراليا يوم 15 نوفمبر 2016 تحت عنوان: "أفكار ستغير العالَم World-Changing Ideas Summit "، هذه الأفكار مبنية أساساً على استخدام العاثيات للقضاء على البكتريا الضارة. وقد صرَّحتْ الباحثة "هيندريكسون" من جامعة ماسي بأوكلاند-نيوزيلاند قائلةً: "بما أن جسم الإنسان يحتوي على المليارات من أنواع البكتريا المختلفة والتي أغلبها غير ضار للإنسان، بل مفيد له؛ حيث تمد الجسم بعناصر وفيتامينات وتساعد في عملية الهضم وحماية صحة الإنسان، يصاحب هذا العدد الهائل من البكتريا في جسم الإنسان؛ عددٌ أكبر من العاثيات، حيث تكون النسبة عشرة عاثيات لكل خلية بكتيرية، وتلعب هذه العاثيات دور أساسياً في الحفاظ على التوازن والثبات بين أنواع البكتريا".
تقوم العاثيات التي تملأ أنوفنا بقتل البكتريا الضارة الموجودة في الهواء حين دخول إلى الأنف خلال عملية التنفس.
تُعتبر المحيطات أكثر البيئات الحاضنة للعاثيات على كوكب الأرض؛ تليها التُربة وأمعاء الإنسان
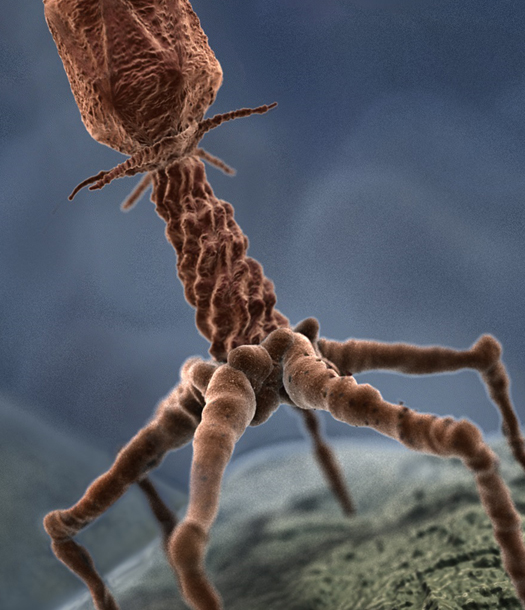
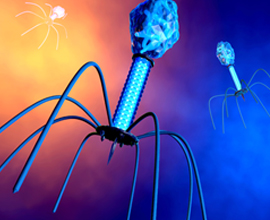
تُعتبر تركيبة العاثيات في غاية البساطة، فبعض الأنواع تتكون من رأس مُكعب وذيل منقبض، وهذا الأخير مزود بألياف وظيفتُها تحسُّسُ الطريق بحثا عن البكتريا، وعندما تصل إليه؛ ترتبط به عن طريق مستقبلات خاصة، ويبدأ الذيل في الانقباض ليحقنَ الحمض النووي الموجود في الرأس إلى داخل خلية البكتريا. عندما يُصبح الحمض النووي داخل البكتريا يسيطر عليها تماماً ويعمل على استنساخ ملايين النسخ منه، وبعد إتمام عملية الاستنساخ التي تصل إلى ملايين النُّسَخ، تنفجر البكتريا وتخرج العاثِيات الجديدة لتكرار إصابة بكتريا أخرى. عن طريق استخدام التحاليل الجزيْئِية والبصمة الوراثية.
يسعى الباحثون لعزل العاثيات سواء الموجودة في الإنسان أو في التربة وغيرِها من المصادر التي يُحتمَل وجود العاثية فيها، وجمع المعلومات اللازمة عنها والتعرف بخصائصها العلاجية تمهيدا للاستفادة منها في العلاج والقضاء على البكتريا الممرضة للإنسان. تعتبر دول أوروبا الشرقية سبّاقة إلى استخدام العاثيات في علاج عدد من الأمراض، إلا أن العلماء يخشوْنَ من الآثار السلبية لهذا النظام العلاجي، بسبب إمكانية حدوث تفاعلات عكسية بسبب بروتين العاثية حين دخولِه جسم الإنسان باعتبارِه جسماً غريباً.
نشير إلى أنه تم استعمال هذه العاثيات كدواء في روسيا بديلٍ عن المضادات الحيوية، خاصة في فترات الحروب. وهنا نورد حالة لِرَجلٍ يُدعى "ألفريد جيرتلر" (ذكرتْهُ هندريسكون خلال الندوة)، حيث جرب هذا الرجل كافة المضادات الحيوية كي يُعالج جرحا أصيب به في ساقه أثناء ممارستِه رياضة التسلق، وكان السبيل الوحيد أمام الأطباء لعلاجِه هو بتر ساقه، إلا أنه وبعد استخدام بكتيريا العاثية لمدة لم تتجاوز عشرة أيامٍ؛ شُفِيَ تماماً وانقذتْ ساقُهُ من البتر.
المراجع:
- Abdul-Hassan HS, El-Tahan K, Massoud B, Gomaa R. Bacteriophage therapy of Pseudomonas burn wound sepsis. Ann Med Burn Club. 1990; 3:262–264.
- Sulakvelidze A, Kutter E. Bacteriophage therapy in humans. In: Kutter E, Sulakvelidze A, editors. Bacteriophages: Biology and Application. Boca Raton, FL: CRC Press; 2005. pp. 381–436.
- Sulakvelidze A, Barrow P. Phage therapy in animals and agribusiness. In: Kutter E, Sulakvelidze A, editors. Bacteriophages: Biology and Application. Boca Raton, FL: CRC Press; 2005. pp. 335–380.
- Kutter E. Phage Therapy: Bacteriophages as naturally occurring antimicrobials. In: Goldman E, Green LH, editors. Practical Handbook of Microbiology. Boca Raton, FL: CRC Press; 2008. pp. 713–730.
- Górski A, Borysowski J, Miedzybrodzki R, Weber-Dabrowska B. Bacteriophages in medicine. In: Mc Grath S, van Sinderen D, editors. Bacteriophage: Genetics and Microbiology. Norfolk, UK: Caister Academic Press; 2007. pp. 125–158.
- Harper DR, Kutter E. Bacteriophage: therapeutic use. Encyclopedia of Life Sciences. John Wiley & Sons, Ltd.; 2009. pp. 1–7.
- Kutter E, De Vos D, Gvasalia G, Alavidze Z, Gogokhia L, Kuhl S, et al. Phage therapy in clinical practice: treatment of human infections. Curr Pharm Biotechnol. 2010;11:69–86. doi: 0.2174/138920110790725401.
بريد الكاتب الالكتروني: redataha962@gmail.com




3 التعليقات
Zubitano24 أكتوبر, 201911:39 م
وقُل رب زدني علماً
باركَ الله جهودكم، وأرضى معبودكم، ورحمَ جدودكم، ورفع بالعلم سدودكم
عيسي هشام16 يناير, 201912:41 ص
,طلب توجيه
هل يستخدم هذا الدواء لانقاذ بتر رجل مصابة بالسكري ارجو الرد باقرب وقت